论文题目:Bone metastases diminish extraosseous response to checkpoint blockade immunotherapy through osteopontin-producing osteoclasts
发表期刊:Cancer Cell
影响因子:44.264
发表时间:2025年6月
通讯作者:Qi-Jing Li(新加坡A*STAR)、贾罄竹&朱波(第三军医大学)
DOI:https://doi.org/10.1016/j.ccell.2025.03.03
研究缘起——当骨骼成为免疫治疗的“暗礁”
近几年,免疫检查点抑制剂(ICB)改写了多种实体瘤的生存曲线。然而在临床门诊里,医生们很快注意到一个现象:一旦患者合并骨转移,原本有效的PD-1/PD-L1抗体常常“哑火”。到底是药物无法进入骨组织,还是骨转移制造了全身性的免疫抑制?这篇刊登在Cancer Cell上的最新研究给出了连贯而扎实的答案。
作者首先利用5个癌种、总计1800余例的真实世界数据证明:与没有骨转移的患者相比,骨转移人群接受ICB治疗时,中位无进展生存期缩短了两到三倍,而这一差异在化疗或靶向治疗队列中并未出现。换言之,骨转移对ICB疗效的干扰似乎具有特异性。
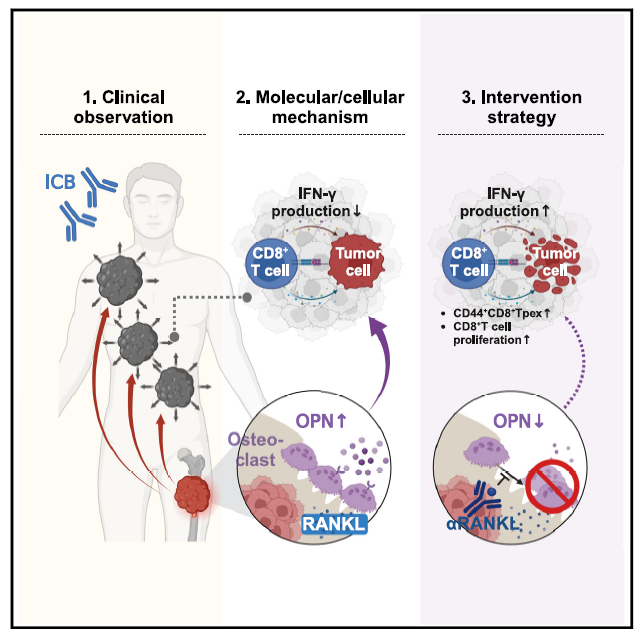
研究路线——临床发现如何被追踪到分子靶点
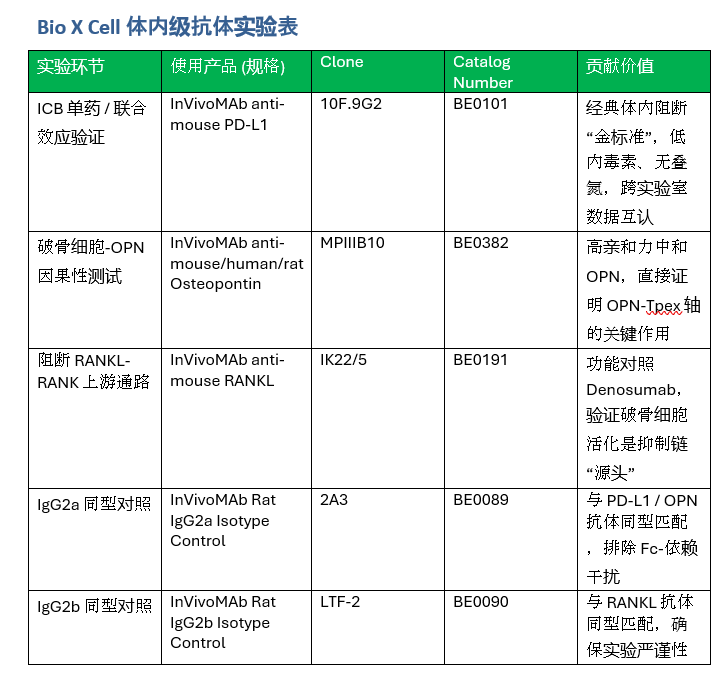
为了验证“骨转移产生远程免疫抑制”这一假设,研究团队建立了“皮下+骨髓内”双瘤小鼠模型。实验鼠体内同时拥有胫骨髓内肿瘤和皮下肿瘤,后者可以用来模拟骨外病灶。给药阶段,研究者选用了Bio X Cell的InVivoPlus anti-PD-L1(clone 10F.9G2)进行多次腹腔注射,其低内毒素、无叠氮的配方保证了免疫研究的可重复性。结果显示,只要小鼠携带骨内肿瘤,皮下肿瘤即刻对PD-L1抗体丧失敏感性。
到底是谁在骨里暗中“策反”了全身免疫?血清蛋白质组学锁定骨桥蛋白Osteopontin(OPN)为最显著升高的因子。进一步的体外培养发现,肿瘤“重编程”的破骨细胞大量分泌Osteopontin。当研究者使用Bio X Cell的中和抗体InVivoMAb anti-OPN(clone MPIIIB10)或是在破骨细胞中特异性敲除Spp1(OPN 基因)时,远端皮下肿瘤对ICB的响应被成功恢复。与此同时,RANKL抗体(Bio X Cell InVivoMAb anti-RANKL,clone IK22/5)或临床已上市的Denosumab同样可以阻断破骨细胞活化,印证了RANKL–破骨细胞–OPN这条轴线是导致免疫耐药的上游事件。
单细胞转录组与TCR谱系配对测序进一步揭示机制:在高OPN环境下,维持抗肿瘤火力的TCF1⁺ Tpex细胞出现锐减,并迅速滑向衰竭型Tex亚群。而当OPN被中和或破骨细胞功能受到抑制后,Tpex库重新充盈,PD-L1抗体的抑瘤效果同步恢复。由此,一条从骨内肿瘤出发、经血循环、最终影响远端肿瘤免疫微环境的信号通路被完整串联起来。
实验方法——临床数据与多维模型的“接力跑”
为了从临床现象追溯到分子靶点,研究团队设计了一条环环相扣的技术路线:
1. 真实世界数据验证
研究者整合了肺癌、乳腺癌、前列腺癌、肾癌和黑色素瘤5个ICB队列(共1800余例),比较骨转移与非骨转移患者的无进展生存期(PFS)与客观缓解率(ORR)。同时,选取匹配人群接受化疗或靶向治疗作为对照,以排除治疗方式本身造成的偏差。
2. 动物模型构建
在C57BL/6小鼠体内同时植入胫骨髓内肿瘤与皮下肿瘤,模拟“骨内+骨外”双灶。PD-L1功能阻断使用Bio X Cell的InVivoPlus anti-PD-L1(clone 10F.9G2),每周腹腔注射。为了追踪骨转移对远端肿瘤的影响,小鼠接受连续活体荧光成像与体积测量。
3. 血清蛋白质组与因子筛选
在动物模型及患者血样中进行无标记质谱,用火山图筛选显著上调蛋白。Osteopontin以最高倍数差异入选候选靶点。随后,研究者建立体外破骨细胞分化体系,采用肿瘤条件培养基刺激,实时定量PCR与ELISA 双管齐下测定Spp1表达。
4. 功能与因果验证
为确认OPN的必要性和充分性,团队采用两条平行策略:
中和抗体:使用Bio X Cell InVivoMAb anti-OPN(clone MPIIIB10)在肿瘤负荷小鼠体内持续给药;
条件敲除:构建Ctsk-Cre::Spp1^fl/fl小鼠,特异性剔除破骨细胞中的OPN。此外,为阻断破骨细胞活化,上游采用了Bio X Cell InVivoMAb anti-RANKL(clone IK22/5)及临床等价物Denosumab。各干预组均在ICB基础上联合给药,以评估疗效恢复幅度。
5. 单细胞组学与 TCR 追踪
肿瘤组织进行scRNA-seq与scTCR-seq。研究者聚焦TCF1⁺的“先导耗竭型”CD8⁺ Tpex细胞,对比干预前后细胞谱系转化与克隆扩增,并通过流式细胞术与免疫荧光验证IFN-γ、TNF-α等效应因子表达水平。
6. 回顾性联合治疗评估
最后,作者回溯150例接受Denosumab+ICB的骨转移患者,对比双膦酸盐+ICB组的影像学缓解及PFS,同时监测血清OPN动态,验证动物数据在真实世界中的可迁移性。
研究结论——一条可被“截断”的远程免疫刹车
综合动物实验、单细胞组学以及回顾性临床分析,论文得出了三点关键结论:
1. 骨转移会系统性削弱ICB疗效,其机制并非药物分布受限,而是免疫学层面的远程抑制。
2. 破骨细胞分泌的Osteopontin是核心介质。一旦阻断OPN或阻断RANKL激活链条,全身范围内的ICB耐药即可被逆转。
3. 循环OPN可作为预测ICB疗效的生物标志物。在真实世界队列中,血清OPN水平越高,患者对ICB的客观缓解率越低;而Denosumab降低OPN后,患者预后得到显著改善
研究意义——从骨髓生态学到联合疗法新思路
这项工作把骨骼从传统意义上的“转移靶器官”上升为“全身免疫调控枢纽”。它提示我们,治疗晚期癌症时若忽视骨—免疫—肿瘤的三边互动,可能低估了耐药的复杂性。更重要的是,本研究给出了一种可执行的解题策略:利用Denosumab或针对OPN/RANKL的中和抗体与PD-1/PD-L1抗体联合,有望让骨转移患者迎来第二次治愈机会。随着多中心前瞻性试验的推进,OPN或将成为临床上“既是靶点,也是标志物”的双重角色分子。
Bio X Cell体内级抗体的科研价值
从PD-L1功能验证,到RANKL阻断,再到OPN因果性测试,Bio X Cell三支抗体贯穿了整条证据链。超低内毒素、无叠氮的即用型制剂不仅保证了动物实验的安全性和一致性,也让来自不同实验室的数据可以无缝对接。难怪PD-L1 clone 10F.9G2一支抗体就在PubMed被引用超过一千次;而RANKL与OPN抗体的应用也正迅速扩散到骨—免疫交叉研究的更多新靶点。对想要深耕免疫耐药机制、并寻求快速验证假说的科研团队而言,Bio X Cell或将成为不可或缺的“实验语言”。

Bio X Cell,赋能每一次科学探索。

更多产品详情,请联系Bio X Cell授权一级代理商—欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州: 020-87615159
代理品牌网站: www.nbs-bio.com
自主品牌网站: www.neobioscience.net
